COVID-19 治療薬の副作用の仕組みを解明 ー受容体経路を抑制することで副作用改善の可能性ー(モドミクス医学分野:魏教授)
【発表のポイント】
⚫ COVID-19 治療薬として使われるレムデシビルについては、頻度は低いものの心機能の副作用が報告されていましたが、そのしくみは不明でした。
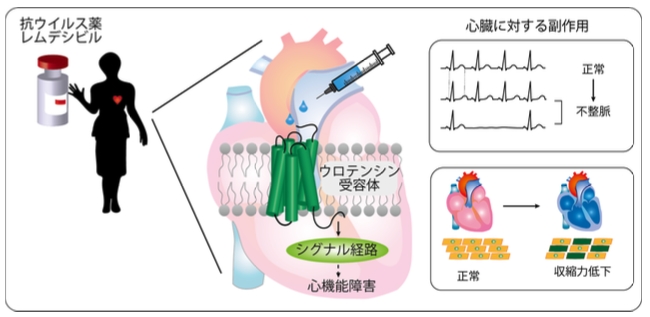
⚫ 受容体を網羅的に探索することにより、レムデシビルが心筋細胞に発現するウロテンシン受容体 (注 1) を活性化することを見出しました。
⚫ レムデシビルの副作用は、ウロテンシン受容体経路を抑制することで改善される可能性が示されました。
【概要】
COVID-19 に対する抗ウイルス薬として使用されるレムデシビルは、頻度は低いものの、洞性徐脈(どうせいじょみゃく)(注 2) や低血圧、QT 時間 (注 3) 延長といった心機能への副作用が報告されており、その影響が懸念されています。しかし、その機序は不明でした。
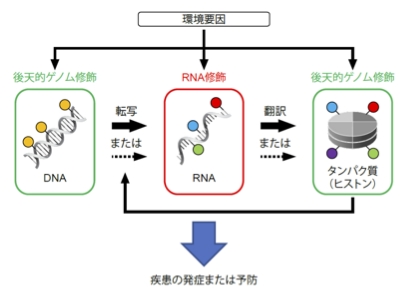
東北大学加齢医学研究所の小川亜希子助教、魏范研教授、同大学医学部生の大平晟也氏、大学院薬学研究科の井上飛鳥教授らは、九州大学大学院薬学研究院、国立医薬品食品衛生研究所との共同研究により、レムデシビルが心筋細胞に発現するウロテンシン受容体 (注 1) を活性化することで受容体応答を引き起こし、心機能に影響を与えることを発見しました(図 1)。
核酸の一種であるアデノシンが細胞膜上に存在する受容体を活性化することは古くから知られていましたが、そのアナログ製剤であるレムデシビルの受容体活性については知られていませんでした。本研究で新たに明らかにした受容体経路を抑制することで、レムデシビル使用による副作用の改善が期待されます。
本研究結果は5月12日付で科学誌 Communications Biology に掲載されました。
図1 本研究の概要
【用語説明】
注 1.ウロテンシン受容体
受容体とは外界や体内からの何らかの刺激を受け取るタンパク質で、多くは細胞膜に存在しています。ウロテンシン受容体はウロテンシンⅡ(UTⅡ)と結合し、心血管収縮あるいは神経伝達などの作用を持つことが知られています。
注 2.洞性徐脈
心臓の拍動のリズムは正常ながら、脈が遅い状態。安静時の心電図で脈が50/分未満のものを言います。
注 3.QT 時間
心電図における心室興奮の始まりから消退するまでの時間。この時間が長くなると重篤な不整脈を発症する恐れがあります。
【お問い合わせ先】
<本研究に関すること>
東北大学加齢医学研究所 モドミクス医学分野 教授 魏 范研、助教 小川 亜希子
E-mail:fanyan.wei.d3*tohoku.ac.jp
akiko.ogawa.e5*tohoku.ac.jp
(*を@に置き換えてください)
<報道に関すること>
東北大学法人東北大学加齢医学研究所 広報情報室
TEL:022-717-8443
E-mail : ida-pr-office*grp.tohoku.ac.jp
(*を@に置き換えてください)