免疫細胞の炎症制御「硫黄代謝」がカギ 〜マクロファージの硫黄代謝を標的とした創薬にむけて〜(遺伝子発現制御分野:本橋教授)
【発表のポイント】
⚫ 炎症を制御する細胞であるマクロファージにおいて、炎症の終結に必要な代謝パスウェイ(注1)を同定しました。
⚫ 炎症刺激により活性化したマクロファージは、含硫アミノ酸であるシスチンを細胞外から取り込み、超硫黄分子(注2)を産生することで、炎症反応を終結させることを明らかにしました。
【概要】
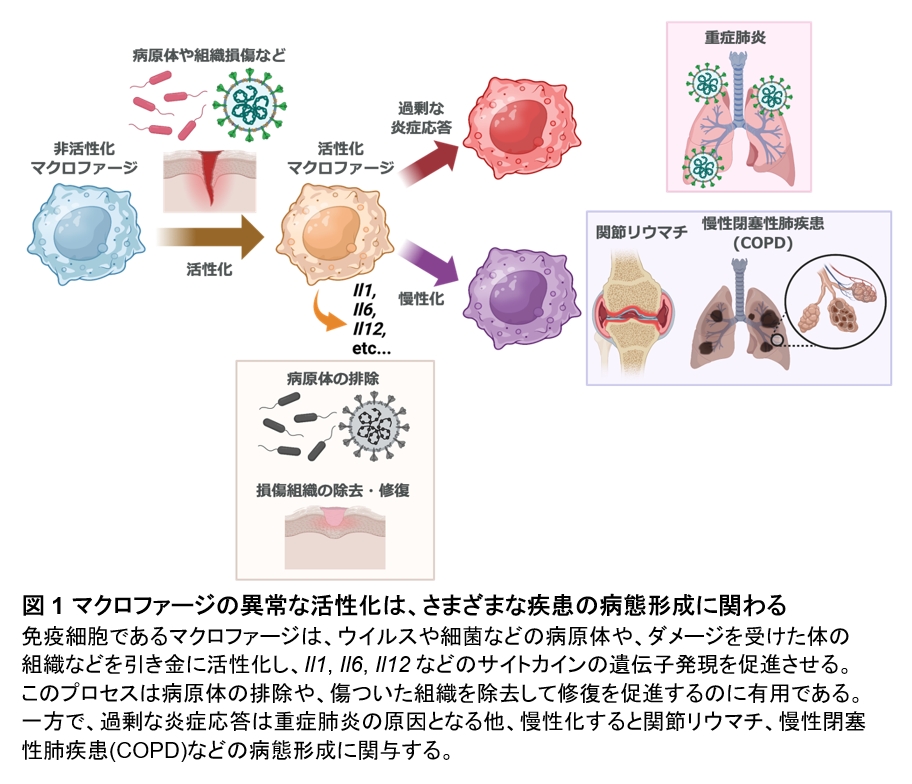
マクロファージは免疫細胞の一種であり、病原体の感染や周りの細胞の損傷等により活性化し、病原体の排除や組織の修復を行います。しかし、過剰に活性化すると新型コロナ感染症で見られるような重症肺炎などの原因となる他、炎症が長引くと慢性閉塞性肺疾患などの慢性炎症性疾患、関節リウマチなどの自己免疫疾患ほか、さまざまな病気を引き起こします。
私たちが持っている細胞は本来、炎症反応を収束させ、過剰な炎症反応が起こることを防ぐメカニズムを兼ね備えていますが、マクロファージにおいて、その制御に関わる因子の全貌は明らかにされていませんでした。
東北大学大学院医学系研究科の武田遥奈大学院生、加齢医学研究所環境ストレス老化研究センターの村上昌平助教、加齢医学研究所遺伝子発現制御分野の関根弘樹講師、本橋ほづみ教授らの研究グループは、マクロファージによる炎症反応の収束には「硫黄代謝」の活性化が鍵となることを明らかにしました。本研究では、マクロファージが取り込んだシスチンとその還元型であるシステインを基質として超硫黄分子が合成され、過剰な炎症応答を収束させるネガティブフィードバック機構が形成されることを明らかにしました。本研究成果は、マクロファージが本来持っている超硫黄分子による炎症抑制機構を強化することが、重症感染症や慢性炎症、自己免疫疾患などの創薬標的となる可能性を示唆しています。
本成果は、8月1日に欧州の学術誌 Redox Biolog 誌に掲載されました。
なお、本成果は熊本大学大学院生命科学研究部微生物学講座・澤智裕教授、九州大学生体防御医学研究所附属高深度オミクスサイエンスセンター・馬場健史教授、新潟大学医学部保健学科・佐藤英世教授、東北大学大学院医学系研究科環境医学分野・赤池孝章教授との共同研究により得られたものです。
【用語説明】
注1. 代謝パスウェイ:
代謝物が複数のタンパク質の働きによって変化していく一連の経路。
注2. 超硫黄分子:
硫黄原子が直列に連結した構造(硫黄カテネーション)を有する分子の総称。システインパースルフィドやグルタチオンパースルフィドなどがある。
【お問い合わせ先】
<本研究に関すること>
東北大学加齢医学研究所 遺伝子発現制御分野 教授 本橋 ほづみ
E-mail:hozumi.motohashi.a7*tohoku.ac.jp
(*を@に置き換えてください)
<報道に関すること>
東北大学法人東北大学加齢医学研究所 広報情報室
TEL:022-717-8443
E-mail : ida-pr-office*grp.tohoku.ac.jp
(*を@に置き換えてください)