| 教授 | 博士(医学) 田中 耕三 |
| 助教 | 博士(理学) 家村 顕自 |
| 助教 | 博士(医学) 國安 絹枝 |

がん化およびがん治療のターゲットとしての細胞分裂制御機構の解明
がんの本質は細胞の無秩序な増殖です。私たちの体も1個の受精卵が60兆個に増殖(分裂)してできますが、それぞれの細胞には46本の染色体が正しく受け継がれています。一方がん細胞のほとんどでは染色体の数や構造の異常が見られ、これは細胞分裂の際に染色体が正確に分配されないこと(染色体不安定性)が原因で起こります。この染色体不安定性は単なるがん化の結果ではなく、がんの発生や進展と密接に関連しているのではないかと考えられますが、そのはっきりしたしくみはわかっていません。私たちは細胞分裂を制御するしくみを明らかにすることにより、がんでどのようにして染色体不安定性が起こるのかについて研究しています。一方細胞分裂期は抗がん剤が作用する時期としても重要であり、私たちは新たながん治療の開発にも取り組んでいます。
1) 染色体分配制御の分子機構の解明
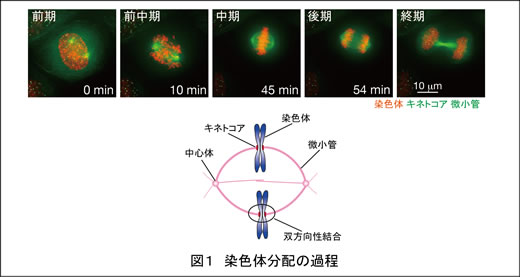
細胞分裂期には、複製された一対の染色体(姉妹染色分体)が2つの中心体から伸びる微小管とキネトコアで結合し(双方向性結合)、別々の中心体へと引っ張られることによって分配されます(図1)。この染色体の分配が正確に起こるために、細胞には紡錘体チェックポイントをはじめとする様々な制御機構が存在し、私たちはその解明に取り組んでいます。
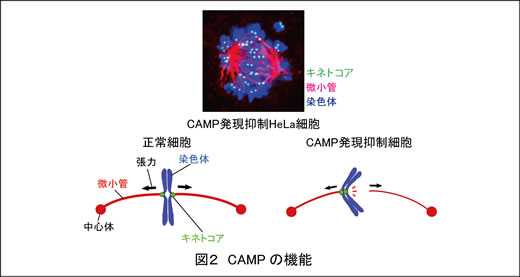
例えば私たちは染色体分配に関係する新たな分子を発見し、CAMP (Chromosome alignment-maintaining phosphoprotein)と名付けました。CAMPの発現をノックダウンした細胞では、染色体が均等に分配されずにばらばらになってしまいます(図2)。研究の結果、CAMPは染色体と微小管の結合の維持に必要であることがわかりました(EMBO J 2011)。現在CAMPのノックアウトマウスの解析を進めています。
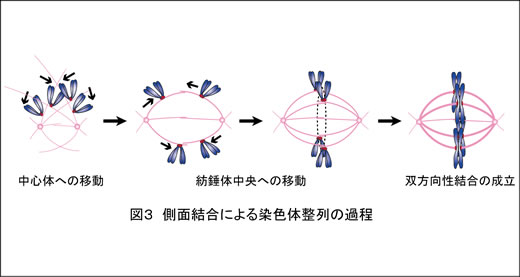
この他にも核膜複合体の構成因子であるNup188が、中心体に局在して染色体分配に関与することや(Cancer Res 2013)、微小管結合因子CLIP-170が分裂期キナーゼPlk1のキネトコア局在にはたらいていること(J Cell Sci 2014)を明らかにしています。また私たちは田中の留学中の酵母での研究をふまえ(Nature 2005, J Cell Biol 2007, Dev Cell 2011)、染色体が微小管によって捕捉され、紡錘体上で双方向性結合を形成するしくみを解明しようとしています。とくに、キネトコアと微小管末端との結合(末端結合)が成立する前に微小管側面と結合する過程(側面結合; 図3)に焦点をあてています。
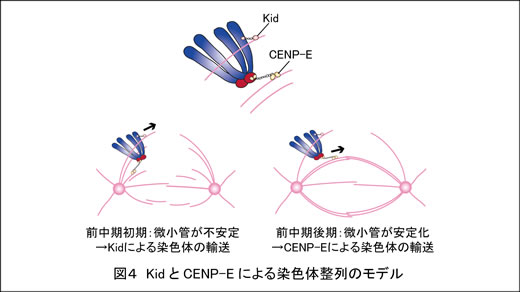
最近私たちは、微小管側面に結合した染色体が紡錘体中央に集まる過程に、KidとCENP-Eという2つのモーター分子がはたらいていることを明らかにしました(図4; Nat Commun 2015)。
さらに、これらの正確な染色体分配を司る機構の異常が染色体不安定性をひきおこすかどうかを検討し、がん化との関連について調べています。
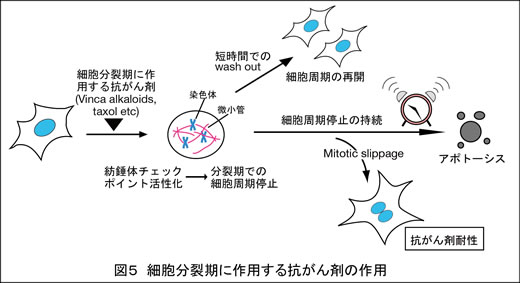
2) 細胞分裂期に作用する抗がん剤の開発
Vinca alkaloidやtaxolといった抗がん剤は、悪性リンパ腫や乳がんをはじめとする多くのがんの治療に広く用いられています。これらの薬剤は微小管に作用し、染色体と微小管の正しい結合を妨げることにより、紡錘体チェックポイントを活性化させます(図5)。この紡錘体チェックポイントの活性化が持続すると、細胞が死に至ると考えられますが、その機構の多くは明らかになっていません。私たちは出芽酵母でも同様のしくみで細胞死が起こることを報告しました(FEBS Lett 2010)。一方一部の細胞は分裂期での停止から逸脱して細胞周期を再開し(mitotic slippage)、これは薬剤耐性につながると考えられます。現在ヒト細胞を用いて、分裂期での停止後の細胞死が効率よく起こり、薬剤耐性が起こりにくいような抗がん剤の開発を目指しています。
染色体が分配される様子はとてもダイナミックで、100年以上にわたって研究者を魅了してきました。私たちは先入観にとらわれず、顕微鏡で直接染色体の動きを観察し、そこからいろいろな仮説を立てて検証していくという姿勢を大切にしています。そしてこれまで述べたような研究によって、がん化の機構の解明、抗がん剤耐性の機序の解明、個々のがん症例における抗がん剤の効果の予測、抗がん剤の効果の制御などに貢献することを目指しています。

