| 特任教授(研究) | 医博 高井 俊行 [Researchmap] |
| 助教 | 博士(医学) 謝 玉婷 |
| 技術補佐員 | 林 佳代子 |
| 事務補佐員 | 中村 孝子 |
| 非常勤講師 | 博士(障害科学)坂本 譲(東北学院大学教授) |
| 分野研究員(非常勤) | Ph.D. 蘇 美慈(陽明交通大学助教) |
| 分野研究員(非常勤) | 博士(医学) 乾 匡範(愛知医科大学講師) |
「FAINを標的にした創薬を目指して」
教授の定年退職に伴い2023年3月末で遺伝子導入研究分野の25年半の歴史にいったん区切りをつけ,同4月1日から新たに同分野の活動がスタートしました。
過去25年間の研究内容としては一貫して免疫制御レセプターのはたらきをアレルギーや自己免疫疾患,遺伝性疾患との関係において解析して参りました。この間,抑制性Fcレセプターや独自に発見した新しい抑制性レセプターPIR-Bの機能が不十分になることが,全身性エリテマトーデス(SLE)に代表されるような自己免疫疾患の素因となることを報告しました(1, 2)。またミエロイド系細胞に発現するLILRB4という抑制性レセプターがSLE患者の自己抗体を産生する病原性プラズマセル表面に異所性に高発現するという知見から,LILRB4発現が病原性を持つ意外な一面も大学病院の先生方との共同で報告しました(3)。このような免疫機構の変調が骨形成や認知症にも関与する可能性を示すこともできました(4)。
新しい遺伝子導入研究分野では,がん・SLE・神経変性疾患の克服に向け,私たちの研究の総仕上げとして制御レセプターを標的とした創薬研究に注力します。たとえば負の方向への免疫制御は,生体が本来持っているがんに対してはたらく免疫を弱めるという「免疫チェックポイント」のコンセプトが指摘されていましたが,これを阻害すると実際にがんに明確な治療効果が見られることが実証され臨床応用されています。私たちの研究していたLILRB4もがん免疫に関与するのではないかという単純な発想で調べてみますと,明らかにこれを阻害するとがん免疫が増強しました(5)。また私たちは独自に,20年ほど謎のまま残されていたLILRB4の生理的リガンドタンパク質が,フィブロネクチンN末端30キロダルトン(FN30)であることを突き止めました(6)。私たちはFN30とLILRB4の結合阻害ががんやSLEの抗体医薬として社会実装される可能性に期待して特許を申請し(7),LILRB4抗体医薬を実際にがん患者さまにお届けできる日が来ることを切に願っています。
さて,LILRB4とFN30との結合はどのように細胞機能を変化させるのでしょうか。この問いに対する答えは,私たちはインテグリンの制御にあると考えています。つまりこれまでフィブロネクチンなどの細胞外マトリクス成分をキャッチすることで細胞接着を開始させ,運動,増殖,分化などに繋げる重要な細胞表面上の分子,インテグリンにはそれを抑制するような仕組みが知られていませんでしたが,私たちはこの抑制分子のうち一つがLILRB4である証拠を得ました(8)。このような抑制機能を持つ分子は,インテグリンの形成する焦点接着斑(Focal Adhesion)の場で抑制する分子という意味合いでFocal Adhesion Integrin Inhibitor,FAIN(ファイン)であると命名しました(図1)。FAINの抑制の仕組みはマクロファージや樹状細胞,破骨細胞,マスト細胞などに普遍的に備わっていることも分かってきましたし(9-11),リンパ系細胞にも存在している可能性もあります。現在はこの機構がどのようにがんやSLE,神経変性疾患の発症に繋がるのかを探求しているところです。FAINの機構がより明確になれば,よりよいがん抗体医薬の開発,SLEの病原性細胞を制御する方法,アルツハイマー病の新しい治療方策が見つかるかもしれません。
新しい遺伝子導入研究分野を宜しくお願い致します。
1. Takai T. Roles of Fc receptors in autoimmunity. Nat Rev Immunol. 2002 Aug;2(8):580-92. doi: 10.1038/nri856.
2. Takai T, Nakamura A, Endo S. Role of PIR-B in autoimmune glomerulonephritis. J Biomed Biotechnol. 2011;2011:275302. doi: 10.1155/2011/275302.
3. Inui M, Sugahara-Tobinai A, Fujii H, Itoh-Nakadai A, Fukuyama H, Kurosaki T, Ishii T, Harigae H, Takai T. Tolerogenic immunoreceptor ILT3/LILRB4 paradoxically marks pathogenic auto-antibody-producing plasmablasts and plasma cells in non-treated SLE. Int Immunol. 2016 Dec;28(12):597-604. doi: 10.1093/intimm/dxw044.
4. Koga T, Inui M, Inoue K, Kim S, Suematsu A, Kobayashi E, Iwata T, Ohnishi H, Matozaki T, Kodama T, Taniguchi T, Takayanagi H, Takai T. Costimulatory signals mediated by the ITAM motif cooperate with RANKL for bone homeostasis. Nature. 2004 Apr 15;428(6984):758-63. doi: 10.1038/nature02444.
5. Su MT, Kumata S, Endo S, Okada Y, Takai T. LILRB4 promotes tumor metastasis by regulating MDSCs and inhibiting miR-1 family miRNAs. Oncoimmunology. 2022 Apr 5;11(1):2060907. doi: 10.1080/2162402X.2022.2060907.
6. Su MT, Inui M, Wong YL, Takahashi M, Sugahara-Tobinai A, Ono K, Miyamoto S, Murakami K, Itoh-Nakadai A, Kezuka D, Itoi S, Endo S, Hirayasu K, Arase H, Takai T. Blockade of checkpoint ILT3/LILRB4/gp49B binding to fibronectin ameliorates autoimmune disease in BXSB/Yaa mice. Int Immunol. 2021 Jul 23;33(8):447-458. doi: 10.1093/intimm/dxab028.
7. 免疫チェックポイント阻害剤(以下略) 出願中
8. Itoi S, Takahashi N, Saito H, Miyata Y, Su MT, Kezuka D, Itagaki F, Endo S, Fujii H, Harigae H, Sakamoto Y, Takai T. Myeloid immune checkpoint ILT3/LILRB4/gp49B can co-tether fibronectin with integrin on macrophages. Int Immunol. 2022 Jul 26;34(8):435-444. doi: 10.1093/intimm/dxac023.
9. Takahashi N, Itoi S, Su MT, Endo S, Takai T. Co-localization of Fibronectin Receptors LILRB4/gp49B and Integrin on Dendritic Cell Surface. Tohoku J Exp Med. 2022 Jun 25;257(3):171-180. doi: 10.1620/tjem.2022.J014.
10. Su MT, Ono K, Kezuka D, Miyamoto S, Mori Y, Takai T. Fibronectin-LILRB4/gp49B interaction negatively regulates osteoclastogenesis through inhibition of RANKL-induced TRAF6/TAK1/NF-kB/MAPK signaling. Int Immunol. 2023 Mar 14;35(3):135-145. doi: 10.1093/intimm/dxac051.
11. Miyamoto S, Chiba T, Itoi S, Su MT, Takai T. LILRB4/gp49B Co-Localizes with Integrin via Fibronectin at Focal Adhesion Sites on Mast Cells. Tohoku J Exp Med. 2023 Mar 10;259(4):273-284. doi: 10.1620/tjem.2023.J001.
-
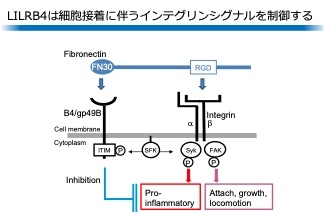
図1 FAIN分子としてのLILRB4
